背景
生物の遺伝情報を担うDNAは、細胞分裂の際に正確にコピーされて二倍となった後、それぞれの娘細胞に分配される必要がある。このように細胞が分裂増殖する過程を細胞周期と呼ぶ。細胞周期において、細胞が分裂する時期をM期(mitosis)、DNAを複製する時期をS期(synthesis)と呼ぶ。またこれらの間に介在する二つのギャップ期をG1期およびG2期と呼ぶ。細胞周期はG1期→S期→G2期→M期→G1期…というように一方向性に回転する。細胞周期の進行はcyclin-cyclin dependent kinase(CDK)複合体により制御され、この複合体により標的タンパク質がリン酸化されることで次のステージに進むことができる。(Fig.1)
cyclinの発現量は細胞周期依存的に変動する。一方、CDKの発現量は細胞周期を通じて一定であるが、リン酸化修飾などによってその活性が制御されることも知られる。また、cyclin-CDK複合体に結合することでCDKのキナーゼ活性を阻害するたんぱく質としてCDK inhibitor(CKI)が知られており、これらも細胞周期の制御に重要な役割を果たしている。
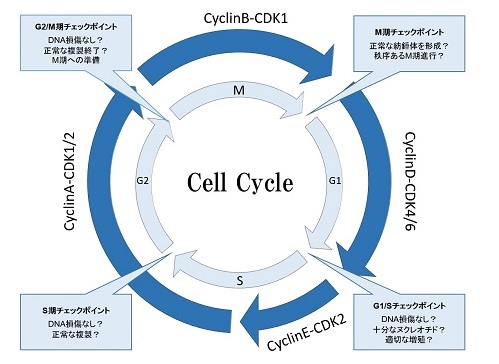
Fig.1 細胞周期
細胞周期はG1→S→G2→M→G1の順に進行する。細胞周期の進行はCDKによる制御を受けており、G1期にはcyclinD-CDK4/6、S期開始にはcyclinE-CDK2、S期及びG2期にはcyclinA-CDK2、M期にはcyclinB-CDK1が機能する。
真核細胞には、DNAを一回の細胞周期で一度のみ複製するための制御機構としてDNA複製ライセンス化反応が存在します。
この反応は複製開始点認識複合体(origin recognition complex:ORC)結合することで始まります。このORCの結合に依存してCdc6,Cdt1がクロマチン上に結合してこれらの介在によってDNA複製に必須なMcm2-7複合体がクロマチン上に導入されることが分かっています。
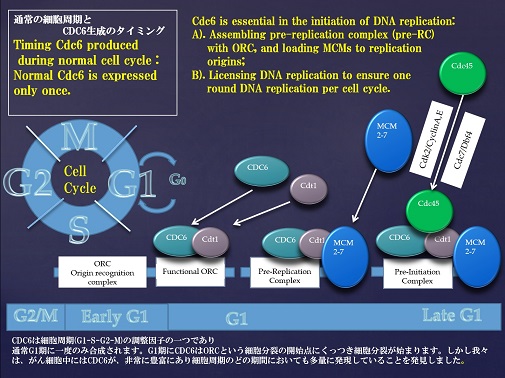
Fig.2
細胞周期に関する主な研究
1.細胞周期の異なる期にある細胞の融合実験(Rao & Johnson, 1970年)
a) M期が最も優位であった
⇒ M期誘導因子の存在を示唆。
b) 次にS期が優位。S期が終了しないとG2/M期に入らず
⇒ S期終了のモニター機構の存在を示唆。
c) M期を経ないと再びS期に入らず
⇒ DNA再複製の禁止現象。
2.卵成熟促進因子(maturation-promoting factor: MPF)の発見(増井や金谷, 1970年代)
MPFはカエルやヒトデの卵成熟を誘導する因子として見出されたが,真核細胞のM期に普遍的に存在することがわかった。
⇒ M期促進因子(M-phase promoting factor)と再命名された。
3.酵母の細胞周期制御に関する遺伝学の研究(Hartwellら, 1970年代)
cdc(cell division cycle)変異株*の研究から,出芽酵母のCDC28遺伝子,分裂酵母のcdc2遺伝子が同定された。
cdc2のヒトホモログの単離・同定(Nurseら,1987年)
⇒ Cdc2(CDK1)は全真核細胞に共通の酵素
4.サイクリンの発見(Hunt & Ruderman, 1980年代)
海産無脊椎動物卵の細胞周期の進行に応じて周期的に変動するタンパク質(サイクリン)を発見
⇒ サイクリンA,Bと命名された。これらはM期の終わりに消失する。
1986年にcDNAがクローニングされた。そのmRNAをカエル卵に注入すると卵の成熟が誘起された。
5.MPFの単離(Lohka & Maller, 1988年)
カエル卵の精製MPF:34kDaと46kDaの複合体で、Ser/Thrキナーゼ活性をもつ。
分裂酵母ではCdc2とCdc13(酵母のサイクリンB)の複合体 ⇒ MPFの実体はCdc2とサイクリンBの複合体。
序論
実際に、Cdt1を過剰発現させるとDNAの再複製が誘導されることやがん細胞においてCdt1の発現が亢進していることが知られています。また、本学会のグループでは、神経細胞芽種の細胞(neuroblastoma cell line)にCdc6が過剰に発現していることを確認している。(Fig.3)
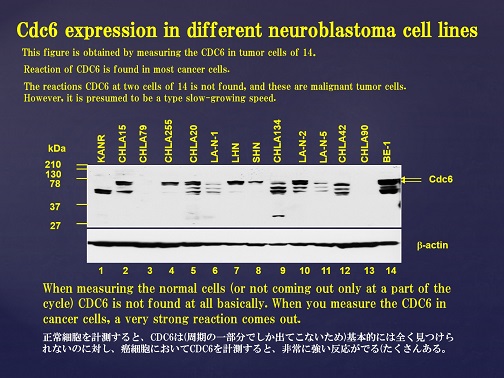
Fig.3
また、ヒト乳がんの細胞(MCF7)でCdc6をノックダウンすると、がん抑制遺伝子P16INK4aが活性化することを確認しています。更に本学会のグループは、p16ががん抑制遺伝子のRbたんぱく質のリン酸化部位を脱リン酸化することを確認しました。(Fig.4)
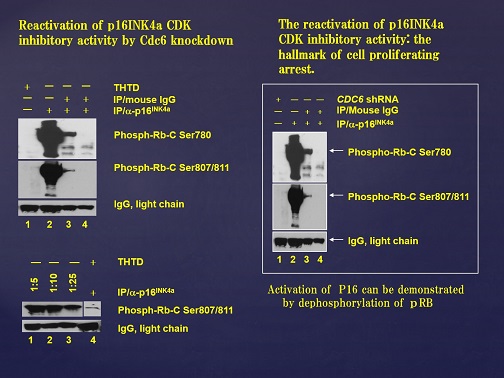
Fig.4
がん細胞は、繰り返されるDNAの再複製によって、無限の増殖能力を獲得していると考えられるので過剰なCdt1やCdc6の発現を制御することが、がん治療にとって重要であると考えた本学会の研究グループは、Cdc6の伝令RNAに相補的なsiRNAを作成し、RNA干渉によってCdc6の発現をノックダウンさせることが、がん治療の有効な手段の開発につながると考え、本学会の臨床研究グループにおいてその有効性と安全性に関する臨床研究開発を行っています。
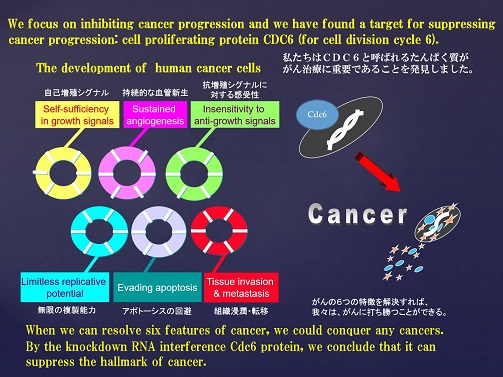
Fig.5
特許出願番号:JP2013/071731
特許公開 W02015020215A1:特許公開 2015年2月12日
レンチウィルスベクターthtd、該thtdを含有する老化剤、がん抑制剤および医薬品組成物、ウィルス様中空粒子で包装されたタンパク質、並びにウィルス様中空粒子の製造方法
細胞周期
生物の遺伝情報を担うDNAは、細胞分裂の際に正確にコピーされて2倍となった後、それぞれの娘細胞に分配される必要がある。このように細胞が分裂増殖する過程を細胞周期と呼ぶ。細胞周期において、細胞が分裂する時期をM 期(mitosis)、DNAを複製する時期をS期(synthesis)と呼ぶ。またこれらの間に介在する2つのギャップ期を G1期およびG2期と呼ぶ。細胞周期はG1期→S期→G2期→M期→G1期…というように一方向性に回転する。細胞周期の進行はcyclin-cyclin dependent kinase(CDK)複合体により制御され、この複合体により標的タンパク質がリン酸化されることで次のステージに進むことができる。
cyclinの発現量は細胞周期依存的に変動する。一方、CDKの発現量は細胞周期を通じて一定であるが、リン酸化修飾などによってその活性が制御されることも知られる。また、cyclin-CDK複合体に結合することでCDKのキナーゼ活性を阻害するたんぱく質としてCDK inhibitor(CKI)が知られており、これらも細胞周期の制御に重要な役割を果たしている。
細胞周期において最も重要なことは母細胞から娘細胞へ遺伝情報が正確に伝達されることである。そのため、ゲノム上のすべての領域が一回の細胞周期において一度だけS 期にのみ複製されることが重要である。これを制御する機構としてDNA複製ライセンス化機構やチェックポイント機構が存在する。
1) DNA複製ライセンス化反応関連たんぱく質
1)ORCは出芽酵母の自律複製配列(Autonomously replicating secuence:ARS)を特異的に認識してATP依存的に結合するたんぱく質複合体として同定されました(Bell and Stillman,1992)。ORCは、6つSubuit(Orc1~Orc6)で構成され、ORC1、ORC4、ORC5は、AAA+ATPase Familyに共通のATP結合モチーフを持っています。OriginへのORCの結合はATPを必要としていることが知られていますので、すべての真核生物において構造的、機能的に保存されていることが明らかとなっています(Gilbert,2001)。
2)Cdc6(Cell division cycle6)は出芽酵母において、細胞増殖に必須な因子として同定されました(Grallert and Sipiczki,1991;Lisziewicz et al,1988)。
Cdc6はAAA+ATPhase Familyに属して、Orc1と高い相同性を示し、WallkerAを介したATPとの結合により、Cdc6はクロマチン上に結合し、WalkerBによるATP加水分解によりMcm2-7複合体がクロマチン上に導入する(Tnaka et al,1997;Donovan et al,1997;Herbig et al,1999)出芽酵母およびヒトにおいては、Orc1との結合が報告されている(Saha et al.,1998;Wang et al.,1999)。また、ORC‐Cdc6複合体がリング構造を取ることが報告されており、Mcm2-7複合体をクロマチン上へ導入する際のloaderとして機能すると考えられている(Speck et al.,2005)。
分裂酵母においてCdc18を高発現すると過度の複製を起こすことが明らかとなり、再複製を抑制するためにライセンス化因子の制御が重要であることが示唆されている(Nishitani and Nurse,1995)。
3)Cdt1(Cdc10-dependent transcript 1)
Cdt1は分裂酵母においてS期に必要な遺伝子の転写にかかわる転写因子Cdc10のターゲットの一つとして同定された(Hofmann and Beach,1994)。その後、アフリカツメガエル卵抽出液を用いた実験系において、すでに同定されていたライセンス化因子であるRLF-Bと同一のものであることが明らかとなった(Tada et al.,2001;Chong et al., 1995;Tada et al.,1999)。
Cdt1を卵抽出液中から免疫除去するとMcm2-7複合体のクロマチンへの結合が起こらないことから、ライセンス化に必須であることが明らかとなった(Maiorano et al.,2000)。さらにCdt1はOrc2およびMcm2-7複合体と結合することが報告されている。
また、マウスにおいてDNAに直接結合することも報告されている(Yanagi et al.,2002)分裂酵母ではCdt1の高発現がCdc18によるDNAの過剰複製を増強し、哺乳類においてはCdt1の過剰発現によりDNAの再複製を起こす(Nishitani et al.,2000; Vaziri et al.,2003)。
このためCdt1の制御が再複製の抑制に重要であると考えられている。高等真核生物ではCdt1の分解に加え、gemininによっても制御されている。
4) Mcm(minichromosome maintenance)2-7複合体
出芽酵母においてARSを含むプラスミドを細胞内で安定的に維持するために 必要な遺伝子群としてMCM遺伝子が単離され(Maine et al.,1984)、後にこれらのうちの6種 (Mcm2~Mcm7)からなるMcm2-7複合体が真核細胞のDNA複製に必須であることが明らかになった。6分子は互いに結合して中央に穴の空いたリング構造を形成し、すべての subunitはATP結合ドメインを持つ。Mcm2-7複合体はDNA複製フォークとともに移動し (Aparicio et al.,1997)、いずれかのMcm subunitの欠損はDNA複製フォークの停止を誘発することから(Labib et al.,2000)、Mcm2-7複合体はDNA複製において鋳型DNAを巻き戻すDNA helicaseとして機能すると考えられている。
DNA複製ライセンス化反応とはクロマチン上に複製前複合体(pre-replication complex:pre-RC)を形成する反応でありM/G1期に起こる。まずORCがoriginに結合し、続いてCdc6とCdt1がクロマチン上に結合し、最終的にMcm2-7複合体がクロマチン上に呼び込まれることでpre-RCが形成される。
2) DNA複製の開始
ライセンス化されたoriginはCDKとDDK(Dbf4-dependent kinase)の2つのタンパク質キナーゼの働きにより活性化され、これによってDNA複製が開始される。CDKとDDKは活性が細胞周期依存的に変動し、G1期には活性は低いがS期に進行すると活性が増大する。
DDKのDNA複製における主な基質はMcm2-7複合体のサブユニットであり、CDKによりリン酸化されたMcm2がDDKのよりよい基質となる(Lei et al.,1997;Sato et al.,1997)。リン酸化されたMcm2-7複合体にCdc45やGINSが結合することで複製開始複合体(pre-initiation complex:pre-IC)を形成する。その後、originの巻き戻しとともにDNA polymeraseがoriginに導入され、DNA複製が開始される。巻き戻されて一本鎖の状態になったDNAは、DNA polymeraseによりDNAが合成されるまで一本鎖DNA結合タンパク質複合体(replication protein A;RPA)が結合することで安定化されている。
3) DNA複製ライセンス化反応の調節く質
染色体の複製が細胞周期の進行に従って適切なタイミングで一回だけ起こることは、真核細胞の共通原理である。この原理が成り立つためには、DNA複製開始反応が複製起点当たり1回だけ起こるように再複製の開始を防止する調節機構が必要である。この調節機構として、pre-RCの形成抑制、すなわちMcm2-7複合体の再結合の阻害機構が存在する。
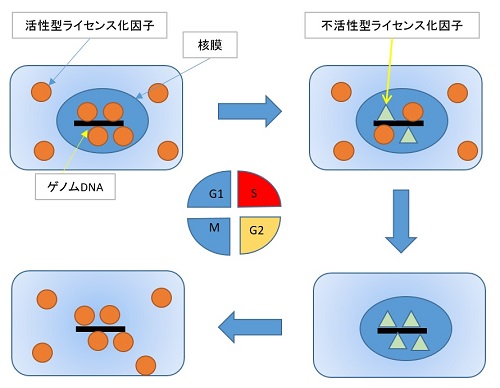
Fig.6.
ライセンス化仮説は1988年にアフリカツメガエル卵から調製した無細胞DNA複製系を用いて得られた実験をもとに提唱された.真核細胞では複製開始を許可するライセンス因子が存在し、染色体DNAに結合する.核内のライセンス化因子は複製開始によって不活性化されるが、M期を経ることによって核膜が崩壊すると再び染色体DNAに結合する.
4) CDKによる調節機構
CDKは、さまざまなcyclinと結合し細胞周期の各ステージの進行に関わるマスター因子として働く一方、染色体の再複製の抑制においても重要な働きをしている。
M期後期にCDK活性が低下するとpre-RCの形成が促進される。その後、核膜形成が起こるとCDK活性が再び上昇し、このCDK活性の持続によりpre-RCの再構築がM期まで阻害される。実際に、CDKがライセンス化に関与するタンパク質をリン酸化することで、それぞれの活性を抑制している例が多数報告されている。出芽酵母ではORC subunitの1つであるOrc2がCDKによりリン酸化を受けてその機能が抑制されることが知られている (Vas et al.,2001)。
gemininによる調節機構
gemininはanaphase-promoting complex/cyclosome(APC/C)を介したユビキチン化を受けM期で分解されるタンパク質として同定された(McGarry and Kirschner,1998)。その後、gemininのcoiled-coil領域のN末側で Cdt1と結合し、coiled-coil領域でCdt1とMcm2-7複合体の結合を阻害することでMcm2-7複合体のクロマチンへの導入を抑えることが明らかとなった (Lee et al.,2004)。APC/Cによるユビキチン化を介してgemininが分解されることによりCdt1が遊離し、ライセンス化が進行すると考えられている。gemininを欠損したヒト細胞ではDN の再複製が引き起こされることが報告されている(Melixetian et al.,2004;Zhu et al.,2004)。このことからgemininによるCdt1の抑制も再複製を抑制するために重要であると考えられる。
Cdc6shRNAによる調節機構
本学会のグループは、Cdc6のmRNAに対して相補的な塩基配列のsiRNAを作成し(特許公開)RNA干渉によるCdc6のノックダウンをヒト乳がん細胞(MCF7)、ヒト神経芽細胞腫(LA-N-2,CHLA255)を用いてVitroでの試験を行った結果、Cdc6の発現をノックダウンできることを確認した。(Fig.7)
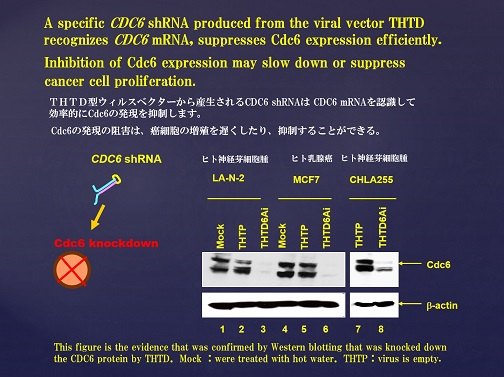
Fig.7
Cdc6とCdt1のクロマチン上への結合はどちらもORCに依存しているが、相互の結合依存性はなく、最終的にMcm2-7複合体を呼び込むためにはCdt1よりも先にCdc6がクロマチン上に結合している必要があることが見出されている(Tsuyama et al.,2005)。
Cdc6とCdt1はMcm2-7複合体の導入には必須であるが、そのクロマチン結合の維持には必ずしも必要ない(Donovan et al.,1997;Maiorano et al.,2000)。すなわち Mcm2-7複合体がクロマチン上に導入されればORC、Cdc6、Cdt1はDNA複製の開始と進行には必要ないと考えられる(Hua and Newport,1998;Rowles et al.,1999;Maiorano et al.,2004)。
本来、Cdc6はS期にCDKによるリン酸化を受けることで分解される(Elsasser et al.,1999)。さらに、出芽酵母ではクロマチン上へ結合していないMcm2-7複合体は CDKによるリン酸化に依存して核外へ輸送される(Labib et al.,1999)。
Cdc6shRNAによるRNA干渉で、Cdc6の発現をノックダウンし、Mcm2-7複合体の形成を抑制することで、DNAの複製が制限されることが示唆され、このことががん細胞において選択的にできうれば、がん治療は大きく前進すると考えられる。
チェックポイント機構
親細胞から娘細胞に遺伝情報を伝達する際、誤った情報が伝えられると細胞死や細胞の癌化といった危険を招きかねない。そこで細胞周期の各ステップを監視する機構としてチェックポイント機構が存在する。
DNAに異常が生じるとチェックポイント機構は細胞周期の進行を停止して異常を修復するための時間を確保し、修復を完了してから次のステップに移行させる。
電離放射線の照射によってDNA二本鎖切断が生じるとATM(ataxia telangiectasia mutated)が活性化される。ATMは毛細血管拡張性運動失調症(ataxia telangiectasia:AT)の原因遺伝子産物として発見されたタンパク質リン酸化酵素であり(Savitsky et al.,1995)、チェックポイント機構の制御因子として機能する。
DNA二本鎖切断により活性化されたATMはChk1やChk2をリン酸化し、CDK2を活性化するCdc25を抑制することで細胞周期を停止させる(Falck et al.,2001;O¶Neill et al.,2002; Sorensen et al.,2003)。
紫外線およびアルキル化剤によるDNA傷害やdNTPの欠乏はDNA複製の停止を引き起こし、これによってATR(ataxia telangiectasia and rad3-related)が活性化される。ATRはChk1のリン酸化を介してCdc25やCdc7を抑制し、細胞周期の停止とDNA複製フォ ークの安定化を誘導する(Nyberg et al.,2002;Costanzo et al.,2003)。DNA複製フォークが崩壊しDNAの切断が起こった場合にはATMも活性化される。
DNA傷害を誘発するとCdt1やCdc6が分解されることが報告されている(Blow and Dutta,2005;Duursma and Agami,2005)。また、DNAの再複製によってチェックポイント機構が活性化することも知られている(Li and Blow,2005)。これらのことからチェックポイント機構とDNA複製ライセンス化機構の連関が示唆される。
このことから、低用量の一部の抗がん剤の使用や低線量の放射線治に対してCdc6shRNAのDNA複製制御機能が合わさり、治療の感受性を上げることが予測される。
本臨床研究の目的
前述したとおり、DNA複製を正常に進行させ、再複製を抑制するためにDNA複製ライセンス化反応関連タンパク質は様々な制御を受けている。とりわけ長大で複雑なゲノムを持つ高等真核生物はより複雑な制御機構を持っていると考えられるが、その詳細は未解明な部分が多い。
細胞周期に依存してタンパク質量が厳密に制御されているCdc6の活性制御機構に焦点をあて臨床研究をおこなっている。
これまでVitroでの当研究において、ヒト幹細胞に精製Cdc6組み換えタンパクCdc6shRNAを添加すると幹細胞の増殖が抑制されることが見出された。(Fig.8)

Fig.8
Cdc6組換えタンパク質Cdc6shRNAの添加によるDNA複製の抑制
DNA複製における新生鎖伸長反応は、鋳型となるDNAがDNA helicaseによって一本鎖DNAに開裂した後に、DNA polymeraseによって進行する。このため、このどちらか一方を阻害することにより新生鎖伸長反応が抑制されるのではないかと予想した。
DNA polymeraseを阻害する抗生物質を加えてアフリカツメガエル卵抽出液にこれを添加することでDNA helicaseは機能し続けるがDNApolymeraseは阻害されるため、一本鎖DNAが露出して一本鎖結合タンパク質であるRPAがクロマチン上に大量に結合する。その結果、ATR-Chk1経路を介したチェックポイント機構が活性化されることが報告されている(Byun et al.,2005)。
DNA複製を1回に制限する必要があるので、CKIとしてCdk2を不活性化するCdc6組み換えCdc6shRNAを1回目のorigin活性化の後に添加することでDNAの再複製を抑止した。
また、アフリカツメガエル卵抽出液無細胞実験系においては20分までにDNA複製ライセンス化反応が完了し、35分までにoriginの活性化が起こる。さらに90分後にはDNA複製が完了する。RPAのsubunitであるRpa30はDNA複製時にクロマチンに結合する。また、DNA複製の開始、複製フォークの進行に関わるCdc45はライセンス化後にクロマチン上に導入され、DNA複製が完了するまでクロマチンに結合する。
結果として、Cdc6ShRNAの添加によりRpa30のクロマチン上への蓄積は観察されなかった。一方、Cdc45はクロマチン上に蓄積し続けているため、DNA複製は完了していないことが確認できる。DNA polymeraseを阻害する抗生物質を添加した場合には、Cdc45と同様にRpa30のクロマチン上への蓄積が見られる。つまり、Cdc6shRNAの添加により一本鎖DNAの過度な露出は起こらないため、Cdc6はDNA polymeraseではなくDNA helicaseを阻害しているのではないかと考えられる。
考察
Cdc6組み換えshRNA添加によって引き起こされるDNA複製の阻害は、Cdt1との複合たんぱくと結合されたMcm2-7複合体を介して誘導される。
Cdc6ShRNAをS期の卵抽出液に過剰に添加した場合には、抗生物質によりDNA複製を停止させた際に見られるようなRPAのクロマチン結合が観察されない。
また、Cdc6組み換えshRNAを添加することによって引き起こされるDNA複製の阻害は DNA helicaseであるMcm2-7複合体を介して誘導されることが示唆されることを確認している。
アフリカツメガエル卵抽出液無細胞実験系において、過剰なCdt1を添加することによりDNAの再複製が誘導されるとチェックポイント機構が働き、更なる複製を抑制することが知られている。しかし、再複製を抑制した状態でCdt1に加えてチェックポイント機構を阻害するcaffeineを卵抽出液に添加してもDNA複製活性は回復しないことから、Cdt1によるDNA複製の阻害はチェックポイント機構とは別の、何らかの経路が働くことにより引き起こされていると考えられてきた(Tsuyama et al.,2009)。
抗生物質aphidicolinはdCTP、dTTPのアナログとして作用することで DNA polymeraseを阻害する。アフリカツメガエル卵抽出液にaphidicolinを添加すると、DNA helicaseは機能し続けるがDNA polymeraseが阻害されるため、一本鎖DNAが露出してそれを保護するRPAが大量に結合する。その結果、ATR-Chk1経路を介したチェックポイント機構が活性化されることが報告されている(Byun et al.,2005)。
Cdt1はPIP boxを介してPCNAと結合することが知られている。また、DNA polymeraseにもPIP boxが存在し(Eissenberg et al.,1997;Bruning and Shamoo,2004)、PCNAがDNA polymeraseの補助因子として働くことで効率よくDNAが合成される。したがって、Cdt1とPCNAが結合することによりPCNAとDNA polymeraseが結合できなくなりDNA複製が抑制されたり、あるいはPCNAを介してCdt1とDNA polymeraseが相互作用しDNA複製を阻害するというような、PCNAを介したDNA複製抑制がCdc6組み換えshRNAにより引き起こされる可能性も考えられる。
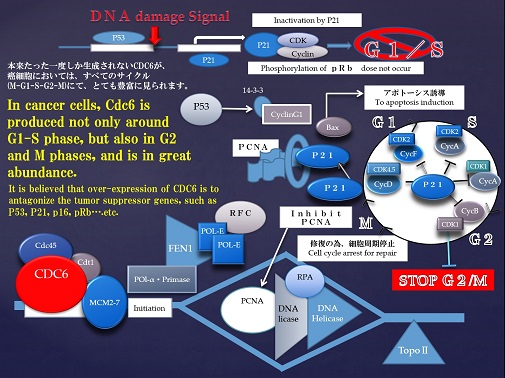
Fig.9
Cdc6とCdt1の複合体はMcm2-7複合体のうちMcm6と結合することが報告されている。しかし、Mcm6のCdt1結合領域はまだ明らかとなっていない。
Cdt1が結合する領域を明らかにすることができれば、この領域に変異をいれた組換えタンパク質を用いてDNA複製を観察することで、さらにはっきりとした証拠が得られるかもしれない。
今後の展望
DNA複製の際、1つのoriginに対して多くのMcm2-7複合体がクロマチン上に結合していることが知られている(Donovan et al.,1997)。
Cdc6とCdt1の複合体がMcm2-7複合体に結合してDNA複製を抑制する際、Mcm2-7複合体がたくさんあるうち、originに最も近いものに結合しているのか、あるいはすべての Mcm2-7複合体に結合しているのかについての研究は明らかにすることができていない。
発がん過程でCdc6とCdt1の発現亢進が認められ、これががん細胞におけるゲノムの不安定化の要因の1つとなっていると考えられている。すなわち、がん細胞では過剰なCdc6およびCdt1が存在した条件下でDNA複製のチェックポイン機能が発動しにくくなっているのかもしれない。今後、本研究の解析をさらに進めることで、がん細胞と正常細胞のDNA複製に関する細胞生物学的性質の違いについて新たな知見が得られ、新たながん医療の手法・戦略を展開する手がかりとなることが期待される。


 先端医療臨床研究会
先端医療臨床研究会